Клиника семейной стоматологии и многопрофильной медицины

Медицина с душой
Работаем: 09:00 – 21:00

Работаем: 09:00 – 21:00
(профессор Щипский Александр Васильевич)
Дентальная импланта́ция – внедрение в костную ткань челюстей конструкций из материалов небиологического происхождения – имплантатов, призванных возместить утраченный зуб и быть искусственной опорой для фиксации съёмных и несъёмных стоматологических протезов. В практике встречаются варианты употребления термина «имплантат» (нем. “implantat“): имплантант или имплант (англ. «implant»), которые являются профессиональным сленгом.
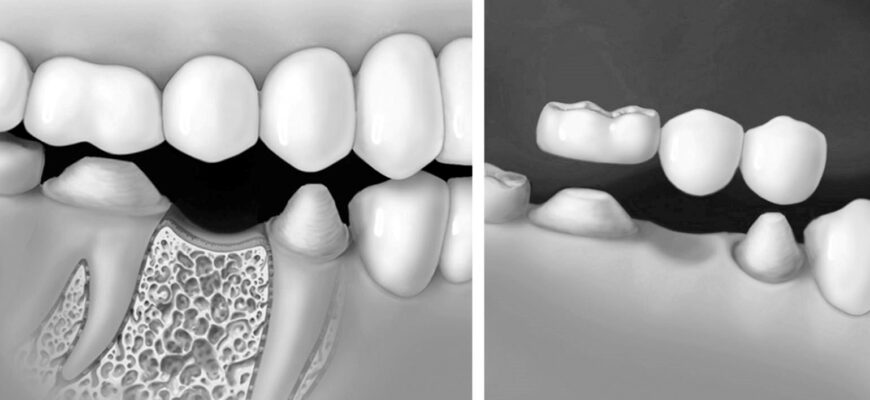
Дентальные имплантаты могут использоваться в качестве дополнительной фиксации съёмных протезов, что значительно повышает их функциональные свойства. Однако основными преимуществами дентальной имплантации является создание условий для наиболее полноценной реабилитации пациентов с частичным или полным отсутствием зубов с помощью несъёмных ортопедических конструкций. Это касается прежде всего клинических случаев с концевыми дефектами зубного ряда или с беззубыми челюстями. У пациентов с включёнными дефектами зубного ряда имплантация позволяет избежать препарирования зубов для создания опор мостовидных несъёмных протезов (рис. 1). При составлении плана комплексного лечения и реабилитации пациенты должны знать о возможностях дентальной имплантации и преимуществах протезирования на имплантатах. Выбор метода протезирования должен осуществляться на принципах информированного согласия.
А
Б

В
Г
А
Б
В
Г
Рис. 1. Варианты протезирования при отсутствии зуба (схема). На рисунках: препарирование зубов рядом с дефектом (а) в качестве опоры для мостовидного протеза (б); сохранение витальности зубов рядом с дефектом (в) в случае протезирования на имплантате (г)
Материалы для изготовления дентальных имплантатов должны обладать определёнными свойствами: биосовместимостью (биоинертностью), прочностью и доступностью для технологической обработки. Биосовместимость определяется химической устойчивостью материала к воздействию среды организма и отсутствием с его стороны токсического воздействия на ткани организма. От материалов, применявшихся в опытном порядке на ранних этапах развития имплантации (например, – пластмассы) и не являвшихся биоинертными, впоследствии отказались. Сейчас для производства имплантатов используют только биосовместимые материалы: титан, тантал, цирконий, керамику. По совокупности положительных характеристик имплантаты чаще изготавливают из титана. Не менее перспективным материалом является цирконий. Однако, в отличие от титана данный материал обладает хрупкостью, устранить которую пока не удаётся. Наряду с этим установлено, что цирконий в сплаве с титаном способен улучшать характеристики последнего и имплантаты из такого сплава пользуются определёнными преимуществами.
Методика имплантации включает ряд последовательных этапов (рис. 2), среди которых: формирование доступа к альвеолярному гребню за счёт препарирования десны, создание в альвеолярной кости ложа для имплантата с помощью фрезы или остеотома, установка имплантата в сформированное ложе, наложение первичных швов.

А

Б

В

Г
А
Б
В
Г

Д

Е

Ё
Д
Е
Ё

Ж

З

И
Ж
З
И
Рис. 2. Примерный протокол установки эндооссального винтового имплантата. На рисунках: а – маркировка места имплантации после раскрытия десны шаровидными борами; б – препарирование ложа имплантата направляющей фрезой и последовательное расширение – фрезами возрастающего диаметра с контролем сформированного ложа глубинометром; в – корректировка ложа имплантата специальными профильными фрезами; г – формирование резьбы с помощью специального метчика в случаях с плотной структурой кости; д – извлечение имплантата из стерильного контейнера с помощью специального ключа; е – введение имплантата в сформированное ложе; ё – ввинчивание имплантата на необходимую глубину по часовой стрелке с помощью ключа и трещотки; ж – удаление ключа и изменение направления хода трещотки; з – удержание имплантата ключом и отсоединение переходника против часовой стрелки с помощью трещотки; и – извлечение переходника. Далее следует закрытие окклюзионного отверстия заглушкой или формирователем и фиксация десны швами в соответствии с особенностями методики
После остеоинтеграции имплантатов следует процедура протезирования, которая предполагает: формирование десневого профиля с помощью формирователей десны, снятие слепка с помощью трансферов, слепочной массы и оттискной ложки, изготовление ортопедической конструкции с помощью моделирования или компьютерного фрезерования, установка абатментов и фиксация ортопедической конструкции с помощью цемента или трансокклюзионных винтов. Представленная схема имеет упрощённый характер. Хирурги при установке имплантатов руководствуются известными базовыми принципами работы с мягкими тканями и костной тканью, а ортопеды при изготовлении протеза – особенностями предстоящей ортопедической конструкции. При этом каждый из представленных этапов может иметь существенные различия в зависимости от вида имплантации, конструкции имплантата, состояния альвеолярной костной ткани и окружающих мягких тканей, опыта и предпочтений хирурга и ортопеда, которые будут рассмотрены более подробно при обсуждении частных вопросов дентальной имплантации и протезирования на имплантатах.
Наиболее распространённым и надёжным способом имплантации является внутрикостная (эндоосальная) имплантация. Внутрислизистая (интрамукозная), субпериостальная, трансостеальная (трансоссальная), эндодонто-эндооссальная (трансдентальная) способы имплантации (рис. 3) в связи с развитием методики эндооссальной имплантации и реконструктивной хирургии на данный момент применяются редко и в основном представляют исторический интерес.
А
Б

В
А
Б
В
Рис. 3. Способы имплантации. На рисунках: а – субпериостальная имплантация, б – трансостеальная имплантация, в – эндодонто-эндооссальная имплантация.
Для проведения эндооссальной имплантации используют пластиночные (рис. 4), цилиндрические (рис. 5) и винтовые (рис. 6) имплантаты. Предпочтение отдают винтовым имплантатам, резьба которых обеспечивает максимальную первичную стабильность имплантированной конструкции и увеличивает площадь соприкосновения поверхности имплантата с костной тканью.

А
Б
А
Б
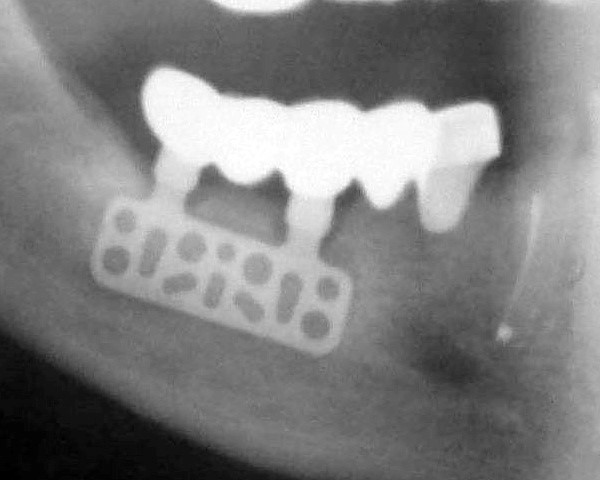
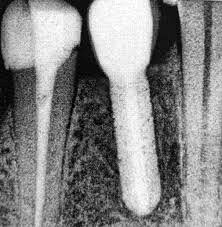
Рис. 4. Эндооссальный пластиночный имплантат. На рисунках: а – вид пластиночного имплантата; б – ретгенографическая картина после протезирования на пластиночном имплантате.
А
Б
А
Б
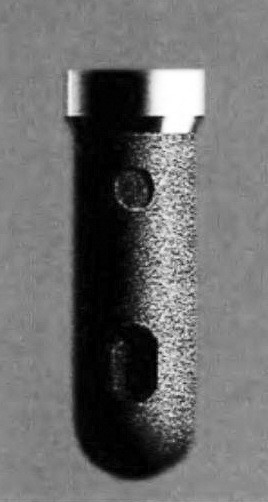
Рис. 5. Эндооссальный цилиндрический имплантат. На рисунках: а – вид цилиндрического имплантата; б – ретгенографическая картина после протезирования на цилиндрическом имплантате.
А

Б
А
Б
Рис. 6. Эндооссальные винтовые имплантаты. На рисунках: а – винтовые имплантаты прямоугольной формы; б – винтовые имплантаты корневидной формы.
В зависимости от типа резьбы винтовые имплантаты могут быть самонарезающими или требующими предварительного нарезания резьбы с помощью метчика. Профиль внутрикостной части имплантатов может быть прямоугольным (рис. 6 а) или конусной (корневидной) формы (рис. 6 б). Конструкция имплантата может быть монолитной (рис. 7) и разборной (рис. 8; рис. 9).

А

Б
А
Б
Рис. 7. Эндооссальный монолитный винтовый имплантат из циркония. На рисунках: а – внешний вид монолитного имплантата из циркония; б – рентгенографическая картина после имплантации монолитного имплантата из циркония.

А

Б
В
А
Б
В
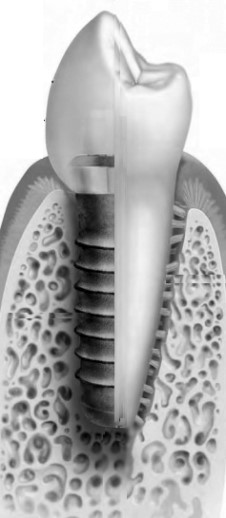
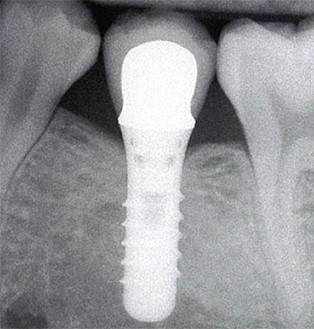
Рис. 8. Эндооссальные разборные винтовые имплантаты “Tissue Level“. На рисунках: а – составные части конструкции имплантата; б – схема установки имплантата; в – ретгенографическая картина после протезирования на имплантате “Tissue Level”.

А

Б
В
А
Б
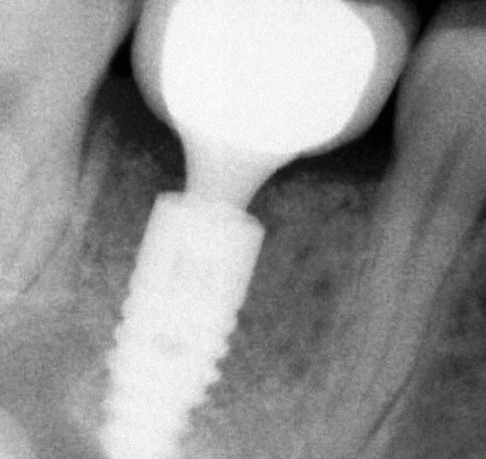
В
Рис. 9. Эндооссальные разборные винтовые имплантаты “Вone Level”. На рисунках: а – составные части конструкции имплантата; б – схема установки имплантата; в – рентгенографическая картина после протезирования на имплантате “Bone Level”.
Неразборные конструкции имеют ограниченное применение из-за необходимости их установки в определённом направлении, что не всегда возможно с анатомо-топографической точки зрения. В таких случаях приходится корректировать наклон внутриротовой части имплантата, что создаёт предпосылки для поломки конструкции. Монолитные конструкции в основном представлены имплантатами из циркония (рис. 7), что обусловлено хрупкостью данного материала. Разборные конструкции эндооссальных винтовых имплантатов изготавливают из титана в виде отдельных частей (рис. 8а; рис. 8б): внутрикостной части или тела, внутриротовой части или абатмента, трансгингивальной части или шейки. При этом возможны варианты. В имплантатах, устанавливаемых по принципу “Tissue level” (рис. 8а), трансгингивальная часть является продолжением внутрикостной части и представлена полированной шейкой. Абатмент и тело имплантата при этом соединяются на уровне десневого края (рис. 8б-в). В имплантатах, устанавливаемых по принципу “Bone level” (рис. 9а), шейка отсутствует, абатмент крепиться непосредственно к внутрикостной части имплантата. Соединение между ними находится ниже уровня или на уровне альвеолярной кости (рис. 9б-в). В комплект входят временные части эндооссальных имплантатов в виде запирающих винтов (заглушек) и формирователей десны. Заглушки заменяют на формирователи десны после интеграции имплантата. В определённых случаях формирователи фиксируют сразу после имплантации. После интеграции имплантатов, непосредственно перед протезированием, с помощью специальной антиротационного соединения в виде шестигранника, восьмигранника и т.п. вместо формирователей к телу имплантатата крепят абатменты. Для создания правильного положения коронки в зубном ряду вне зависимости от направления имплантата производители имплантационных систем представляют возможность выбора абатментов с различными углами наклона. Коронки фиксируют на абатментах с помощью цемента (рис. 10а) или винтов (рис. 10б).
А

Б
А
Б
Рис. 10. Схема фиксации ортопедических конструкций на имплантатах. На рисунках: а – фиксация с помощью цемента; б – фиксация с помощью трансокклюзионных винтов.
Результат дентальной имплантации зависит от первичной стабильности имплантата, которая достигается за счёт правильного выбора диаметра и длины имплантата, компрессионного и ретенционного действия резьбы имплантата, точного препарирования костного ложа и величины костного натяжения, т.е. разницы между диметром имплантата и диаметром сформированного ложа (0,3 – 0,6 мм). Первичная стабильность имплантата является условием возникновения вторичной стабильности за счёт остеоинтеграции имплантата. При подвижности имплантата вместо остеоинтеграции вокруг имплантата может произойти формирование соединительнотканной капсулы. Данный вариант интеграции не способен создать достаточную стабильность искусственной опоры протеза во время жевательной нагрузки. С помощью фиброоссального варианта интегрируются субпериостальные имплантаты и в большинстве случаев – эндооссальные пластиночные имплантаты, что послужило причиной постепенного отказа от их использования.
Феномен остеоинтеграции был открыт в 60-х годах прошлого столетия профессором Пер-Ингваром Бранемарком (P.I. Branemark) (рис. 11), что имело фундаментальное значение для развития дентальной имплантологии. Исследуя в эксперименте микроциркуляцию костной ткани с помощью прибора в корпусе из титана, имплантированного в кость, учёный обнаружил прочный контакт поверхности титана с костью. В дальнейшем была подтверждена возможность плотного соединения костной ткани и имплантата без образования соединительнотканной прослойки (рис. 12). Данный тип морфофункционального взаимодействия имплантатов с костью был назван остеоинтеграцией. Интегрированные таким образом эндооссальные винтовые имплантаты способны выдерживать функциональную нагрузку в течение длительного срока без потери ортопедической конструкции (рис. 12в).

Рис. 11. Профессор P.I. Branemark, основоположник учения об остеоинтеграции

А
Б
В
А
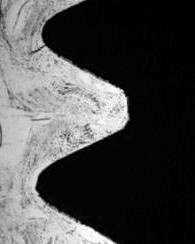
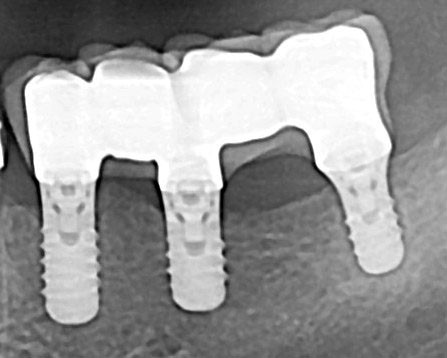
Б
В
Рис. 12. Остеоинтеграция имплантатов. На рисунках: а – поверхность титана до обработки; б – поверхность имплантата после пескоструйной обработки и кислотного травления; в – непосредственный контакт поверхности имплантата с костью обеспечивает стабильность ортопедической конструкции.
Качество остеоинтеграции зависит от химического состава материала, гидрофильности и особенностей обработки поверхности внутрикостной части имплантата. На имплантаты, изготовленные из биосовместимых и биоинертных материалов, отсутствует токсическая и иммунологическая реакция, что создаёт условия для абсорбции на его поверхности белков и адгезии клеток костного матрикса. Активность миграции клеточных элементов в структуру имплантата зависит от смачиваемости его поверхности, которую называют гидрофильностью. Доказано, что имплантаты с гидрофильной поверхностью обладают большим коэффициентом остеоинтеграции. В большинстве случаев имплантаты изготавливают из т.н. “коммерчески чистого титана”, который обладает всеми необходимыми качествами. Степень чистоты титана может быть разной, – от I до V. Чаще всего используют имплантаты из титана IV степени очистки. Доказано, что имплантаты с шероховатой микропористой поверхностью более устойчивы по сравнению с имплантатами с необработанной гладкой поверхностью. Шероховатая поверхность увеличивает площадь соприкосновения с костью и выполняет роль ретенционных пунктов, что позволяет использовать имплантаты меньшей длины и диаметра и проводить имплантацию в клинических случаях с меньшим объёмом костной ткани. Наиболее распространённой технологией создания микропористой структуры является пескоструйная обработка поверхности имплантата. Наибольшей стабильностью обладают имплантаты с поверхностью, микропористая структура которых создана в результате двойной обработки: сначала пескоструйной, затем кислотного травления (SLA-поверхность) (рис. 13).

А

Б
А
Б
Рис. 13. Поверхность титана. На рисунках: а – поверхность титана до обработки; б – поверхность имплантата после пескоструйной обработки и кислотного травления.
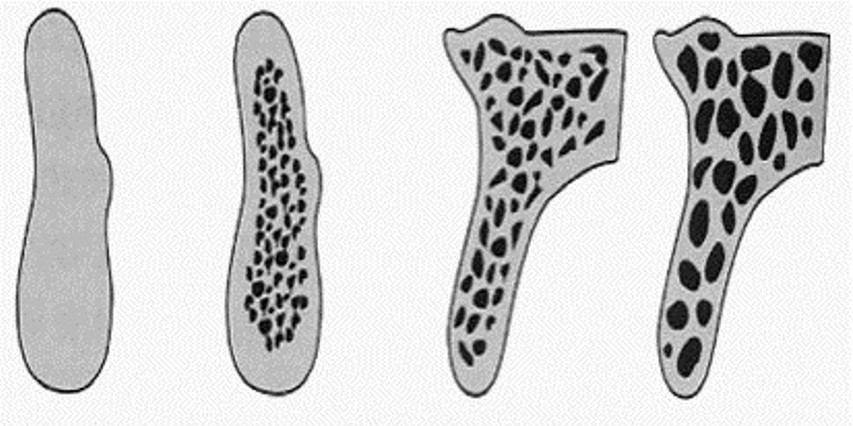
В зависимости от температурного режима кислотного травления поры имплантата могут иметь различную форму и глубину. Таким образом, достигается максимальный контакт между костью и поверхностью имплантата. Кроме того, в процессе нейтрализации кислоты липофильные свойства поверхности имплантата меняются на гидрофильные свойства, что улучшает адгезию протеинов. Известны и другие типы обработки поверхности имплантата: анодное окисление титана, обработка лазером, покрытие титановой плазмой (TPS), гидроксиапатитом (HA) и т.п. При планировании имплантации следует учитывать плотность костной ткани. Известно, что структура нижней челюсти более плотная за счёт преобладания компактной кости, структура верхней челюсти – менее плотная за счёт преобладания губчатой кости. В зависимости от соотношения между компактной и губчатой костью (Lekholm, Zarb, 1985; Misch, 1988 (рис. 14), плотность её структуры разделяют на четыре класса. Первый класс с наиболее выраженной компактной структурой соответствует максимальной плотности кости. Последовательно к 4-му классу количество компактной кости уменьшается, а губчатой кости увеличивается, что соответствующим образом сказывается на плотности костной ткани. Правильный учёт представленных характеристик позволяет принимать оптимальные врачебные решения и сводит очевидные риски к минимуму.

А
Б
А
Б
Рис. 14. Классификация качества (плотности) кости челюстей по Lekholm and Zarb (1985) (а) и Misch (1988) в зависимости от преобладания компактной (I) или губчатой (IV) структур.

Рис. 15. Классификация степени резорбции челюстей по Lekholm and Zarb (1985)
При формировании ложа стоит опасаться не столько механического воздействия на кость, которое можно рассматривать даже в качестве стимула регенерации, сколько – перегрева кости и коагуляции белков, что приведёт к некрозу кости. Для этого препарирование ложа для имплантата производят последовательно с помощью фрез постепенно увеличивающегося диаметра. Диаметр финишной фрезы должен быть на 0,3 – 0,6 мм меньше диаметра устанавливаемого имплантата. В таком случае можно добиться первичной стабильности имплантата, что важно для остеоинтеграции и эффективности имплантации. Физиодиспенсер позволяет регулировать скорость вращения фрезы до безопасных значений, обычно 2000 об./мин, лучше 1000 об./мин вначале процедуры и около 800 об./мин при работе на завершающем этапе, и охлаждать кость во время препарирования с помощью подачи в рану холодного физиологического раствора. Подача охлаждающего раствора может быть внешней, может быть внутренней через фрезу. Внутреннее охлаждение следует комбинировать с внешним охлаждением. Фрезы в процессе эксплуатации следует периодически менять, так как тупые кромки могут вызывать дополнительную нагрузку на кость и приводить к её перегреву. В области верхней челюсти при наличии костной ткани IV типа для препарирования ложа вместо фрез лучше использовать конденсирующие остеотомы возрастающего диаметра. Такая методика позволяет уплотнить структуру костной ткани и улучшить первичную ретенцию установленного имплантата. Нарезание резьбы с помощью метчика после формирования ложа не должно быть самоцелью. Такая манипуляция нужна только в случае склерозированной компактной костной ткани. Во всех других случаях даже обычный винтовой имплантат можно использовать как самонарезающийся. Имплантат ввинчивают по часовой стрелке вручную или машинным способом, отсоединяют переходник и плотно, но без усилия, закрывают резьбу заглушкой или формирователем.
Считается, что для полноценной интеграции имплантатов, установленных в области нижней челюсти, требуется 3-4 месяца, в области верхней челюсти 5-6 месяцев. Данные рекомендации стоит соблюдать, прежде всего, у пациентов с проблемной костью. В других случаях характеристики современных имплантатов позволяют данные сроки сократить, вплоть до 1,5 месяца и 2-х месяцев соответственно. Критериями качества остеоинтеграции являются: неподвижность имплантата, отсутствие воспалительных явлений, дефектов и разрежения кости рядом с имплантатом. Качество вторичной стабильности подтверждается во время смены формирователя и установки абатмента. Если под действием приложенного усилия произошло хотя бы минимальное проворачивание имплантата, остеоинтеграцию следует признать неудовлетворительной и имплантат удалить. В некоторых случаях может произойти стабилизация имплантата, если увеличить сроки наблюдения и провести приём лекарственных препаратов, стимулирующих остеогенез. Существуют аппаратные методы контроля за стабильностью установленного имплантата, причём таким образом можно обнаружить динамику остеоинтеграции, спрогнозировать сроки, необходимые для остеоинтеграции, определить готовность установленного имплантата к запланированной функциональной нагрузке.
Эффективность имплантации, основанная на принципе остеоинтеграции, в динамике допускает ежегодную потерю костной ткани по вертикали не более 0,2 мм. При этом, выживаемость остеоинтегрированных имплантатов через 5 лет функционирования должна составлять не менее 85% случаев, через 10 лет – 80% случаев (Smith, 1987). Наряду с обобщёнными данными, показатели у опытных имплантологов составляют не менее 90%, что подтверждает потенциал данной методики лечения и реабилитации.
Дентальная имплантация может быть проведена по одноэтапному (открытому) или двухэтапному (закрытому) протоколам. В первом случае доступ к альвеолярному гребню для установки имплантата получают с помощью мукотома соответствующего диаметра. Дополнительные хирургические процедуры в таком случае не предусмотрены, так как формирователи десны согласно методике с самого начала находятся в открытом положении. Преимущества данной методики не столь очевидные. Отсутствие визуального контроля во время формирования ложа для имплантата не позволяет должным образом учесть особенности челюсти и может привести к повреждению костной стенки. Кроме того, увеличивается риск инфицирования тканей вокруг установленного имплантата. Двухэтапный протокол предполагает откидывание слизисто-надкостничного лоскута. Визуальный контроль позволяет провести имплантацию с учётом состояния костной ткани. При необходимости имплантация может быть дополнена остеопластикой. Ушивание раны обуславливает необходимость проведения перед протезированием второго этапа операции для установки формирователя десны. Стремиться к герметичной изоляции раны, если это не связано с применением мембраны, не стоит. Достаточно максимально сблизить края лоскута. Швы можно снять через неделю после операции, в некоторых случаях при протяжённой ране – лучше через 10-14 дней, что позволяет стабилизировать контур десны.
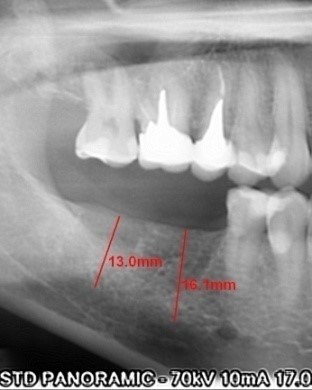
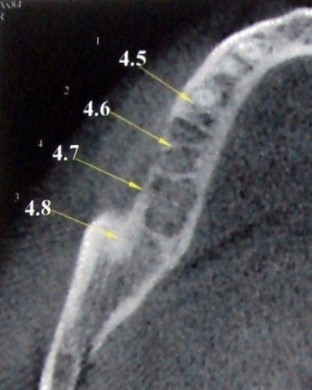
Параметры имплантата должны соответствовать анатомо-топографическим особенностям альвеолярного отростка (части) челюсти. При этом соотношение длины и диаметра имплантата определяет площадь контакта с костью и его стабильность в условиях жевательной нагрузки. Признанного протокола выбора имплантатов с учётом данных параметров до сих пор не существует. Рекомендуется при уменьшении диаметра выбирать имплантаты большей длины и наоборот. При этом следует учитывать, что длина имплантата компенсирует боковые, а диаметр – вертикальные нагрузки. Классическим вариантом является установка в области нижней челюсти имплантатов длиной 10 мм, в области верхней челюсти – 13 мм. При выборе длины имплантата ориентируются на расстояние от альвеолярного гребня до стенки носа, стенки верхнечелюстного синуса или нижнечелюстного канала. Причём, если в первых двух случаях возможна кортикальная фиксация, то до нижнечелюстного канала рекомендовано оставлять расстояние около 2-х мм. Примерно такое же расстояние, не менее 2-х мм, должно быть между соседними имплантатами или между зубами и имплантатами, что важно, в том числе, для формирования десневого сосочка и проведения необходимых гигиенических процедур. Объём костной ткани с наружных сторон имплантата должен составлять не менее 2 мм, ближе к шейке имплантата 1,5 мм, но не меньше 1-го мм. Уменьшение данных параметров может привести к резорбции и атрофии костной ткани. Для замещения моляров должны применяться имплантаты большего диаметра, чем для других участков отсутствия зубов. Соблюсти данные рекомендации на практике сложно без применения вспомогательных реконструктивных процедур. По мере развития методик и технологий появилась возможность применения в необходимых случаях коротких имплантатов длиной 6 мм и даже 4 мм и имплантатов малого диаметра (3,3 мм). Осуществить выбор имплантата с учётом анатомо-топографических соотношений можно с помощью ортопантомографии (рис. 16а; рис. 17а) и компьютерной томографии (рис. 16б-е).
А
Б

В
А
Б
В

Г

Д

Е

Ё
Г
Д
Е
Ё
Рис. 16. Методы планирования имплантации у пациента с отсутствием 46 47 зубов с помощью цифровой ортопантомографии (а) и компьютерной томографии (б, в – топограммы; г, д, е – крос-секции). На ортопантомограмме (ё) – результат лечения в виде мостовидной ортопедической конструкции на имплантатах, установленных в области отсутствовавших 45 47 зубов.

А

Б
А
Б
Рис. 17. Методы планирования имплантации у пациента с отсутствием 36 46 47 зубов с помощью аналоговой ортопантомографии и шаблона в виде металлических шариков определённого диаметра, зафиксированных в полости рта перед проведением рентгенографии (а). На ортопантомограмме (б) – вид после имплантации в области отсутствовавших зубов.
При этом лучше выполнить конусно-лучевую компьютерную томографию, которая исключает образование артефактов при сканировании металлических объектов. Кроме измерения размеров анатомических структур в разных направлениях, программа томографа позволяет определять плотность костной ткани в единицах Хаунсфилда, что также может быть использовано при выборе имплантата. С помощью специальной программы можно поместить в нужный участок альвеолярной кости виртуальный имплантат определённого диаметра и длины. Ортопантомография остаётся самым распространённым методом исследования стоматологического пациента, в том числе при планировании имплантации. Недостатком данного исследования является плоскостной характер получаемого изображения (2D), которое позволяет проводить измерения только в двух направлениях: вертикальном и медиально-дистальном. В большинстве случаев этого достаточно для планирования имплантации. Компьютерные программы аппаратов цифрового поколения позволяют проводить измерения на виртуальной ортопантомограмме с помощью курсора (см. рис. 16а).
Проводить измерения на ортопантомограмме, выполненной в аналоговом режиме, следует с учётом рентгенологического искажения, которое можно уточнить с помощью специального металлического шаблона, помещённого в полости рта перед проведением исследования (см. рис. 17а). Для этого используют формулу:
Х | = | а ● b |
с |
где, Х – реальный размер объекта; a – реальный диаметр металлического шарика (5 мм); b – размер объекта на рентгенограмме; c – диаметр металлического шарика на рентгенограмме.
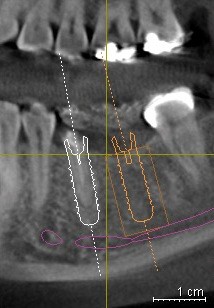
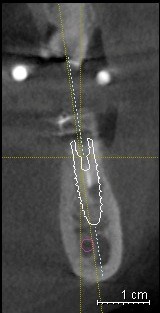
Положение имплантата при возмещении включённого дефекта зубного ряда должно соответствовать направлению корней соседних зубов, наклону альвеолярного отростка верхней челюсти в сторону губы и альвеолярной части нижней челюсти в сторону языка. Следует учитывать, что угол наклона может измениться в результате атрофии альвеолярной кости. Особенно важно правильно расположить имплантат во фронтальном отделе верхней челюсти (рис. 18). Вестибулярное или нёбное расположение имплантата может создать трудности для протезирования и значительные нарушения эстетики у пациентов с открытой линией улыбки. Между установленными имплантатами должна существовать определённая параллельность. Наиболее простым способом её достижения является контроль в качестве ориентира при формировании последующих отверстий на глубинометры, оставленные в сформированных ложах предыдущих имплантатов (рис. 19а).

Рис. 18. Демонстрация оптимального положения имплантата (д) согласно A.Dawson & S.Chen (2009).

А

Б

В
А
Б
В
Г
Д

Е
Ё
Г
Д
Е
Ё
Рис. 19. Методы установки имплантатов в правильном положении. На рисунках: а – формирование ложа с ориентацией на переходники и глубинометры; б – с помощью шаблона, фиксированного на сохранившихся зубах; в – с помощью шаблона, зафиксированного на беззубой челюсти; г, д, е, ж – с помощью компьютерного моделирования.
Для формирования отверстий можно использовать во время операции специально изготовленный шаблон с направляющими втулками (рис. 19б, в). Технологии изготовления шаблонов и методики их использования могут быть различной степени сложности, в том числе с помощью компьютерного моделирования (рис. 19г, д, е, ё). Для этого программы современных конусно-лучевых компьютерных томографов снабжены виртуальными моделями имплантатов различных топоразмеров. Наиболее точными являются шаблоны с фиксацией на соседних зубах (рис. 19б). На беззубых челюстях при применении шаблонов возможна погрешность, которую можно уменьшить с помощью специальных фиксирующих винтов (рис. 19в). Однако даже в случае применения шаблонов приоритетом должен оставаться визуальный контроль за процессом препарирования. Параллельность имплантатов в боковых отделах челюстей не должна восприниматься в качестве правила, из которого не может быть исключений. По клиническим показаниям допустима некоторая девиация положения и направления имплантатов, параллельность которых можно скорректировать с помощью супраструктур, выбрав абатмент с соответствующим углом наклона. Желательно только, что бы наклон не превышал 30°, что может создать проблемы с протезированием (рис. 20). Уменьшить нагрузку на костную ткань можно, расположив несколько имплантатов не в одну линию, а с некоторым смещением.

А

Б
А
Б
Рис. 20. Трудности с протезированием в связи с большим углом имплантата, установленного в области 17 зуба. Протезирование проведено в два этапа: сначала в области имплантата 17 зуба, затем – в области имплантата 16 зуба.
В основе планирования имплантации находится принцип: “один зуб – один имплантат”. Однако данный принцип соблюдается буквально только в случае отсутствия одного (рис. 21а, в) или двух (рис. 21б), рядом располагавшихся, зубов. Хотя при отсутствии 2-х зубов, прежде всего резцов или премоляров, допустимо протезирование с консольным элементом на одном имплантате. При отсутствии 3-х или 4-х, рядом располагавшихся зубов (см. рис. 20а, в), возможно изготовление мостовидного протеза на 2-х опорах, в качестве которых выступают имплантаты. При увеличении дефекта более 4-х зубов следует установить дополнительную опору (см. рис. 20). Причём не столько из-за возможной перегрузки имплантатов и костной ткани, сколько из-за вероятности поломки промежуточной части конструкции мостовидного протеза (рис. 22). Объединение имплантата с зубом единой конструкцией возможно, но нежелательно. Прогноз состояния зуба в таких случаях менее предсказуемый, чем имплантата (рис. 23).

А

Б

В
А
Б
В
Рис. 21. Протезирование на имплантатах при различных вариантах частичного отсутствия зубов: рентгенограммы при включённых дефектах зубного ряда (а, б, в); при концевых дефектах зубного ряда (в).

А

Б
А
Б
Рис. 22. Перелом промежуточной части мостовидного протеза (а) потребовал установки дополнительного имплантата (б).

А

Б
А
Б
Рис. 23. Мостовидный протез на 35 зубе и имплантате в области 37 зуба (а). В динамике имплантат в области 37 зуба сохранил стабильность, культя 35 зуба была разрушена под действием жевательной нагрузки. 35 зуб удалён и одновременно замещён имплантатом (б), созданы условия для протезирования мостовидным протезом на имплантатах в области 35 и 37 зубов. В конечном итоге предполагается вариант мостовидного протезирования на имплантатах, проведённый ранее у данного пациента в области верхней челюсти.
Подвижность зуба или ортопедической конструкции из-за расцементировки конструкции может сказаться и на устойчивости имплантата. На беззубой нижней челюсти для опоры несъемного протеза нужно установить не менее 5 имплантатов), на верхней челюсти – количество имплантатов лучше увеличить до 8 штук (рис. 24).

А

Б
А
Б
Рис. 24. Протезирование на имплантатах при полном отсутствии зубов (удалены во время имплантации). Ортопантомограммы до операции (а) и после протезирования (б).
Наряду с этими рекомендациями, существует концепция “несъёмный протез на четырёх имплантатах”. Отношение к ней неоднозначное, однако в определённых случаях данная методика реабилитации может обсуждаться в качестве приемлемой. При протезировании на беззубых челюстях необходимо стремиться к постановке имплантатов в области отсутствующих клыков, что создает правильную геометрию прикуса и соответствующим образом перераспределяет жевательные нагрузки.
Альвеолярная кость после утраты зубов подвержена постепенной резорбции и атрофии (см. рис. 15), что создаёт серьёзные препятствия для проведения имплантации. Стандарты имплантации по мере приобретения научного опыта, развития методик и технологий постепенно менялись. Вначале имплантацию проводили по принципу “где возможно”, т.е. в участках с достаточным объёмом костной ткани. Это существенным образом ограничивало потребности пациентов в данном методе реабилитации. Внедрение в клиническую практику реконструктивных операций позволило перейти при планировании имплантации к принципу “где необходимо”. На данный момент с помощью соответствующих методик можно восстановить объём кости и установить имплантат в нужном месте, в правильном направлении, оптимальной длины и диаметра. Наиболее известной методикой восстановления альвеолярной кости является т.н. “направленная тканевая регенерация” (Guided Tissue Regeneration – GTR) (рис. 25), которая в дентальную имплантологию пришла из пародонтальной хирургии. В 1983 году исследователи под руководством Ньюмана, в 1988 году – под руководством Данхила провели серию экспериментов на животных, доказав возможность восстановления костной ткани возле имплантата в пространстве, изолированном нерезорбируемой мембраной из политетрафторэтилена. По аналогии метод получил название “направленная костная регенерация” (Guided Bone Regeneration – GBR) (рис. 26).

А

Б

В

Г
А
Б
В
Г
Рис. 25. Направленная тканевая регенерация (Guided Tissue Regeneration – GTR). На рисунках: а – до возникновения пародонтита; б – образование патологического кармана в результате пародонтита; в – изоляция зоны регенерации с помощью мембраны: г – восстановления тканей пародонта и зубодесневого прикрепления в подмембранном пространстве.

А

Б

В
А
Б
В
Рис. 26. Направленная костная регенерация” (Guided Bone Regeneration – GBR). На рисунках: а – атрофия альвеолярного отростка; б – изоляция зоны регенерации с помощью мембраны: в – восстановления костной ткани альвеолярного отростка и протезирование на имплантате.
Мембраны выполняют роль барьера, который предотвращает врастание мягких тканей в зону регенерации костной ткани, из-за чего они получили название барьерных. В таком качестве используют нерезорбируемые и резорбируемые барьерные мембраны. Резорбируемые мембраны в сроки от 2-х до 6 месяцев рассасываются самостоятельно и не требуют проведения дополнительной операции по их удалению. Они не требуют дополнительной фиксации, так как пропитываются кровью и хорошо слипаются с подлежащей поверхностью, хотя в некоторых случаях их всё же фиксируют швами, титановыми винтами или специальными пинами. Наряду с преимуществами, резорбируемые мембраны обладают рядом весьма существенных недостатков, которые ограничивают их применение. Они мягкие и не способны удерживать необходимый объём. В результате прирост кости не всегда является достаточным для формирования профиля кости. В связи с этим самостоятельное применение резорбируемых мембран в имплантологии ограничено. Как правило, их применяют для изоляции костных блоков или остеопластического материала, выполняя в данном случае роль своеобразной “кубышки”, которая удерживает гранулы материала в нужном месте. Резорбируемые мембраны весьма уязвимые. При нарушении лоскута при соприкосновении с полостью рта они, как правило, теряют свои свойства из-за контаминации пищевым детритом и требуют их удаления для купирования воспалительного процесса. В отличие от резорбируемых мембран, нерезорбируемые мембраны через 6 месяцев после операции приходится удалять. Наряду с этим, нерезорбируемые мембраны имеют ряд важных преимуществ перед резорбируемыми мембранами, которые повышают эффективность метода. Некоторые образцы мембран снабжены титановым каркасом, который позволяет сохранять объём регенерации в течение требуемого срока. Кроме того, нерезорбируемые мембраны при отсутствии воспаления в зоне регенерации способны сохранять свои барьерные свойства при соприкосновении с полостью рта, что делает результат регенерации более предсказуемым.
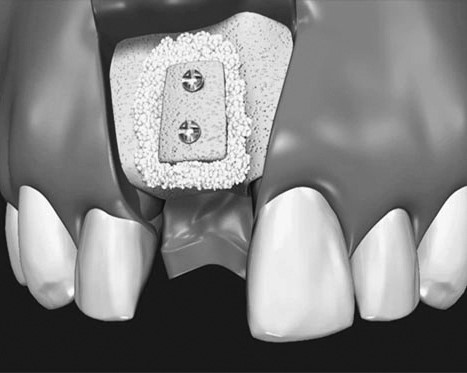
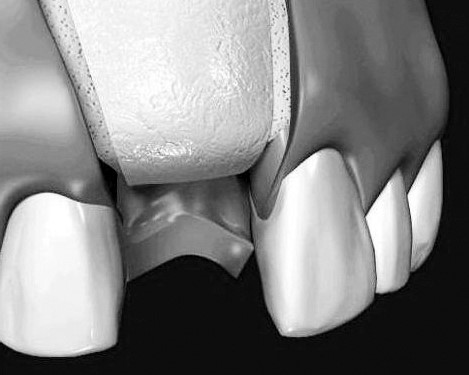
Для возмещения объёма альвеолярной кости используют аутотрансплантаты в виде костных блоков, взятые в донорских участках: подбородочном отделе, ретромолярной области, в области ветви нижней челюсти, бугра верхней челюсти, свода черепа, гребня подвздошной кости, ребра, берцовых костей. Забор блока осуществляют атравматично с помощью фрезы или пьезохирургического инструмента. Сформированный блок фиксируют в нужном участке неподвижно с помощью микровинтов на подготовленную поверхность, закрывают резорбируемой мембраной и тщательно изолируют редрессированным лоскутом (рис. 27). Метод пользуется популярностью из-за возможности получить непосредственный результат при любом варианте атрофии, как горизонтальной, так и вертикальной. Однако эффективность метода не столь очевидная, как это может показаться на первый взгляд. Костные блоки, состоящие в основном из кортикальной кости, плохо реваскуляризуются и в значительной степени резорбируются, что нивелирует первоначальный результат. Из-за этого в предпротезной подготовке от этого метода практически отказались. В имплантологической практике метод продолжают использовать. При этом сначала проводят реконструкцию, затем – имплантацию, что в значительной степени удлиняет процесс функциональной реабилитации пациента.

А
Б
В
А
Б
В
Рис. 27. Реконструкция альвеолярного отростка с помощью костного блока. На рисунках: а – компктостеотомия воспринимающего ложа; б – фиксация костного блока в сочетании с остеопластическим материалом; в – изоляция зоны регенерации барьерной мембраной.
При сужении альвеолярного отростка (части) челюстей после удаления зубов методом выбора является методика расщепления кости (рис. 28). Пространство между разведёнными участками кости заполняют остеопластическим материалом или измельчённой аутокостью. Если операция не сочетается с одновременной установкой имплантата, созданное пространство стабилизируют винтами или кортикальным блоком. Метод требует тщательного ушивания раны, что не всегда просто. Более того, нельзя исключить образования секвестра отломанной стенки кости в результате нарушения васкуляризации или и её прорезывания через истончённую десну. Сходной методикой реконструкции является т.н. сэндвич-остеотомия (рис. 29).

А

Б

В

Г
А
Б
В
Г
Рис. 28. Реконструкция альвеолярного отростка с помощью горизонтального расщепления кости. На рисунках: а – узкий альвеолярный отросток челюсти не соответствует диаметру запланированного имплантата; б, в – этапы расщепления кости; г – вид после расщепления и установки запланированного имплантата.

А

Б

В

Г
А
Б
В
Г
Рис. 29. Реконструкция альвеолярного отростка с помощью вертикального расщепления кости (сэндвич-остеотомия). На рисунках: а – атрофия альвеолярного отростка челюсти не соответствует длине запланированного имплантата; а, б – схема расщепления кости в профиль (а) в анфас (б); в, г – вид после расщепления кости в профиль (в) и в анфас (г).
В отличие от предыдущей методики проводят горизонтальный распил костной ткани с перемещением костного фрагмента вверх, что увеличивает высоту альвеолярной кости. Также, как и в предыдущем случае, образовавшуюся щель заполняют остеопластическим материалом или измельчённой костью, а перемещённый фрагмент – стабилизируют мини-пластинами или костным блоком. Осложнения сэндвич-остеотомии такие же, как у предыдущего метода. Если сэндвич-остеотомия предполагает одномоментное перемещение костного фрагмента, то с помощью специально изготовленного для этих целей компрессионно-дистракционного аппарата участок кости можно переместить вертикально постепенно (примечание: со скоростью около 1 мм в сутки), увеличивая таким образом объем костной ткани за счёт дистракционного остеогенеза (рис. 30).

А

Б
А
Б
Рис. 30. Реконструкция альвеолярной части челюсти с помощью компрессионно-дистракционного метода. На рисунках: а – атрофия альвеолярного отростка челюсти не соответствует длине запланированных имплантатов, после компактостеотомии установлен компрессионно-дистракционный аппарат; б – вид после дистракции альвеолярной части челюсти, высота альвеолярной кости соответствует необходимым для имплантации параметрам.
Условия для имплантации в боковых отделах верхней челюсти определяются анатомо-топографическими взаимоотношениями альвеолярного отростка и верхнечелюстного синуса. Как правило, они неблагоприятные для проведения имплантации. В связи с пневматическим строением синуса и атрофией альвеолярной кости после удаления зубов имплантация в области больших коренных зубов без применения вспомогательных методик чаще всего невозможна. Однако в имплантологии научились данный недостаток эффективно устранять с помощью методики под названием “синуслифтинг” (рис. 31; рис. 32).

А

Б

В
А
Б
В
Рис. 31. Реконструкция альвеолярного отростка с помощью закрытого синуслифтинга. На рисунках: а – атрофия альвеолярного отростка челюсти не соответствует длине запланированных имплантатов, начало остеотомии остотомом наименьшего диаметра в сторону верхнечелюстного синуса; б – завершение остеотомии отстотомом наибольшего диаметра в сторону верхнечелюстного синуса; г – вид после синуслифтинга и установки запланированного имплантата.
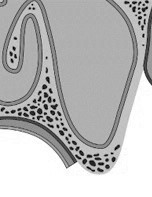
А

Б

В

Г
А
Б
В
Г
Рис. 32. Реконструкция альвеолярного отростка с помощью открытого синуслифтинга. На рисунках: а – атрофия альвеолярного отростка челюсти не соответствует длине запланированных имплантатов, обнажён альвеолярный гребень и передняя стенка верхнечелюстного синуса; б – через трепанационное окно слизистая оболочка синуса перемещена вверх; в – с помощью фрезы сформировано ложе для имплантата; г – вид после синуслифтинга и установки запланированного имплантата, пространство вокруг которого заполнено остеопластическим материалом.
При этом, методика т.н. “закрытого синуслифтинга” (мягкого синуслифтинга) (рис. 31) превратилась практически в рутинную процедуру. При некоторых модификациях суть данной методики заключается в перемещении слизистой оболочки синуса или прослойки костной ткани со слизистой оболочкой синуса в сторону последнего с помощью специальных инструментов – остеотомов. Если для этого использовать компрессионные остеотомы, то последовательно меняя их диаметр помимо увеличения вертикальных параметров кости дополнительно можно уплотнить структуру костной ткани (примечание: особенно если плотность кости III – IV класса) в области формируемого ложа, что позволяет установить имплантат нужной длины в состоянии лучшей первичной стабильности. И это важно, так как именно возможность фиксации имплантата в состоянии первичной стабильности является условием для применения данной методики. Обычно для реализации данного условия должно быть в наличии не менее 5 мм костной ткани. При меньшей высоте кости существует риск смещения имплантата и даже его миграции в верхнечелюстной синус. Обычно для остеогенеза в созданном пространстве достаточно сгустка крови. При необходимости данное пространство можно заполнить остеопластическим материалом. При высоте альвеолярного отростка в проекции верхнечелюстного синуса менее 5 мм создать необходимый объём кости, а следовательно, и условия для имплантации можно с помощью методики под названием “открытый синуслифтинг” (см. рис. 32). Для этого в передней стенке синуса после её обнажения с помощью фрезы или пьезохирургического инструмента, стараясь не повредить подлежащую слизистую оболочку верхнечелюстного синуса, формируют трепанационное окно необходимого размера. Затем слизистую оболочку вместе с подвижным участком костной стенки смещают специальными элеваторами внутрь и вверх синуса. Сформированное пространство заполняют остеопластическим материалом, желательно с добавлением измельчённой аутокости, и ушивают рану. В случае перфорации мембраны Шнайдера (примечание: так называют слизистую оболочку верхнечелюстного синуса) следует отказаться от дальнейшего проведения синуслифтинга или попытаться устранить повреждение с помощью швов и резорбируемой мембраны. Относительным недостатком открытого синуслифтинга является уменьшение моделируемой зоны в процессе остеогенеза. Поэтому желательно заполнять формируемое пространство остеопластическим материалом с гиперкоррекцией. В случае одновременной имплантации, стабилизирующую роль выполняют имплантаты. Пациент перед планированием имплантации в боковых отделах верхней челюсти должен быть хорошо обследован, включая проведение обзорной рентгенографии черепа в носо-подбородочной проекции или, что лучше, компьютерной томографии. При обнаружении признаков хронического верхнечелюстного синусита синуслифтинг и имплантацию следует отложить и провести санацию верхнечелюстного синуса с помощью радикальной операции по Колдуэллу-Люку (возможен эндоскопический вариант санации синуса).
Регенерация костной ткани в относительно небольших пространствах достаточно хорошо идёт через организацию сгустка крови. При больших объёмах существуют риски, связанные с ретракцией сгустка и вероятностью его нагноения. Поэтому большинство реконструктивных операций в имплантологии требуют применения остеопластических материалов. Разобраться в их разнообразии и рациональном применении достаточно сложно. Здесь следует ориентироваться, прежде всего, на чёткое понимание механизма регенерации костной ткани и тех задач, которые являются приоритетными для конечного результата в конкретном клиническом случае. В некоторых случаях достаточно сформировать плотную основу для устранения дефекта и поддержки контура десны и слизистой оболочки в виде т.н. остеоида, в других случаях – следует ориентироваться на формирование костной ткани с типичной для челюсти архитектоникой и характеристиками. При решении данных задач не стоит забывать, что остеогенез является процессом, последовательно состоящим из формирования коллагенового матрикса, минерализации и ремоделирования первичного регенерата.
В интерпретации остеопластических материалов можно встретить разночтения и различные трактовки. Согласно большому оксфордскому толковому медицинскому словарю трансплантатом (transplantat, graft) является любой орган, ткань или часть тела, используемая с целью его замены. В зависимости от происхождения выделяют следующие варианты трансплантатов: аутотрансплантаты (ткани, пересаженные из одной части тела в другую у одного и того же человека); алло- или гомотрансплантаты (ткани, пересаженные человеку от другого человека, т.е. от трупа); ксено- гетеротрансплантаты (ткани, пересаженные человеку от представителя другого вида, т.е. от животного). Таким образом, остеопластические материалы могут иметь биологическое происхождение (аутогенное, аллогенное, ксеногенное). Наряду с ними существуют остеопластические материалы синтетического или природного происхождения (материалы, полученные из минералов, например, – кораллов). Для решения остеопластических задач обсуждаемые материалы должны обладать остеоиндуктивными и остеокондуктивными свойствами, лучше – обоими одновременно. Остеоиндуктивные материалы способны стимулировать остеогенез. Классическим примером таких материалов является аутогенная кость в виде костной стружки или измельчённая в костной мельнице. В отличие от костных блоков, в данном субстрате находится большое количество морфогенетических белков, а сам материал по мере резорбции способен выполнять остеокондуктивную функцию. Такими же свойствами может обладать аллогенная деминерализованная лиофилизированная кость. Однако остеоиндуктивные свойства аллогенной кости должны проверятся производителем. Установлено, что трупная кость обладает остеоиндуктивными свойствами в разной степени, а в некоторых образцах такие свойства могут отсутствовать. Ведущие банки тканей тестируют материал на остеоиндуктивность, что представлено на упаковке. При применении аллогенных тканей могут возникнуть вопросы этического или юридического характера, которые так же необходимо учитывать при планировании реконструктивных операций. К остеопластическим материалам с остеоиндуктивными свойствами можно отнести коллагеновые материалы ксеногенного происхождения. Известно, что коллаген в организме составляет порядка 6% его массы. Из 13 типов коллагена, наиболее распространёнными являются пять типов. Костная ткань представлена коллагеном I типа и в меньшей степени коллагеном V типа. Коллаген способствует стабилизации сгустка крови и привлекает в зону регенерации остеогенные клетки. Учёные выделили из коллагена 15 аминокислот, которые способствуют миграции предшественников остеобластов. На их основе созданы некоторые препараты, данные о которых представлены в специальных руководствах. Применение коллагена является физиологически обоснованным, так как соотносится с фазой формирования коллагенового матрикса и только потом происходит его постепенная минерализация. Остеокондуктивные материалы представлены минеральными препаратами аллогенного, ксеногенного и синтетического происхождения. В зависимости от величины гранул кальцийфосфатной керамики или гидроксиапатита данные материалы подразделяются на рассасывающиеся и нерассасывающиеся. В любом случае гранулы долгое время сохраняются в остеоидном регенерате, частично окружены костной тканью, частично – фиброзной тканью. Остеоид с трудом поддаётся ремоделированию, но способен сохранять форму и поддерживать десневой контур. Применение минеральных остеопластических препаратов продолжает превалировать, зачастую по инерции, хотя в последнее время наметилась тенденция перехода на остеопластические препараты с увеличенной долей коллагена.
Длительное время классическим протоколом имплантации являлась поздняя имплантация, которая проводилась через 6 – 12 месяцев после удаления зубов. Как правило, в эти сроки происходит резорбция лунки и атрофия альвеолярной кости. Она прогрессирует и через 2 – 3 года может достигнуть 40% – 60% от исходного уровня. Данные явления являются наиболее выраженными после множественного удаления зубов. В связи с этим поздняя имплантация зачастую сопряжена с необходимостью проведения дополнительных реконструктивных операций, после которых требуется 6 – 9 месяцев на формирование и ремоделирование регенерата и 4 – 8 месяцев на процесс остеоинтеграции после установки имплантата. Итого, вместе с протезированием на лечение по данному протоколу уходило от 1-го года до 2-х лет. Дальнейшее развитие имплантологии позволило в значительной степени решить данные проблемы за счёт совершенствования хирургических методик, технологических возможностей имплантационных систем, расширения показаний для имплантации. Применение остеопластических материалов после удаления зубов вместо сгустка крови позволило уменьшить резорбцию альвеолярной костной ткани. Применение имплантатов с шероховатостью, сформированной в результате пескоструйной обработки и кислотного травления, позволило уменьшить сроки их остеоинтеграции. Причём, в некоторых случаях весьма существенно, вплоть до 1,5 месяцев. Однако наиболее значимым по своим результатам событием в развитии имплантологии явилось внедрение в практику метода немедленной имплантации (рис. 33).

А

Б

В

Г
А
Б
В
Г

Д

Е

Ё

Ж
Д
Е
Ё
Ж
Рис. 33. Пац. З., 42 года. Продольный перелом корня 11 зуба (а). На рисунках: вид лунки после удаления зуба (б), после установки имплантата (в), после пластики лунки и альвеолярного гребня коллагеном (г). Демонстрация оптимального положения имплантата согласно A.Dawson & S.Chen (2009) (д). Стабильное положение лоскута за счёт матрацного шва (е; ё) и хороший эстетический результат после протезирования (ж).
Имплантаты, установленные в лунку, непосредственно после удаления зуба или в течение 1-й недели после его удаления, могут быть использованы для протезирования уже через 3 месяца, а при благоприятных условиях ещё раньше. Методика немедленной имплантации физиологически обоснованная, так как позволяет использовать первоначальный объём альвеолярной кости и дополнительный потенциал остеогенеза за счёт раскрытия костномозговых пространств, миграции остеогенных клеток при лучшей васкуляризации данного участка кости по сравнению с таковой в области давно удалённого зуба. Во время формирования ложа для имплантата происходит удаление т.н. «пучковой» кости (кортикальной кости лунки, в которую вплетаются волокна периодонта), с которой начинается резорбция альвеолярной костной ткани. Кроме того, стабилизация кости происходит за счёт её плотного механического контакта с шероховатой поверхностью имплантата. Немедленная имплантация имеет психологические преимущества для пациента, так как сокращает количество хирургических процедур и придаёт операции созидательный характер, компенсируя отрицательное восприятие удаления зуба.
Близкими по своим характеристикам к одномоментной имплантации является отсроченная имплантация, проведённая через неделю или в течение 30 дней после удаления зуба. К отсроченной имплантации можно отнести также варианты её проведения в течение 3-х месяцев после удаления зуба. Имплантацию, проведённую в более поздние сроки после удаления зуба после ремоделирования регенерата, относят к поздней имплантации. Отсроченные варианты имплантации носят иногда вынужденный характер в связи с необходимостью купирования активного воспалительного процесса в периапикальных тканях, т.е. в тех случаях, когда удаление зуба являлось частью патогенетического лечения.
Одномоментная имплантация после удаления однокорневых зубов стала распространённым методом лечения и реабилитации пациентов (см. рис. 33). Методика имплантации после удаления многокорневых зубов продолжает активно обсуждаться специалистами. Результаты одномоментной имплантации зависят от первичной стабильности имплантата, сохранности лунки и эффективности решения остеопластических задач. Причём, стабильность имплантата является ключевым фактором для регенерации костной ткани. Даже незначительная подвижность имплантата может нарушить остеогенез и привести к образованию вокруг него фиброзной ткани. Для достижения первичной стабильности имплантат должен иметь хотя бы 30% контакт с костной тканью. Для одномоментной имплантации рекомендуют использовать имплантаты конической (корневидной) формы, однако цилиндрические имплантаты зачастую можно установить в состоянии большей первичной стабильности за счёт дополнительного препарирования и углубления в альвеолярную кость (см. рис. 4). Необходимо учитывать плотность костной ткани и в зависимости от этого выбирать имплантаты с более выраженными компрессионными свойствами резьбы. Результаты одномоментной имплантации при наличии периапикальных очагов хронической инфекции напрямую зависят от санации лунки зуба. При формировании ложа для имплантата его положение не обязательно должно повторять лунку зуба (см. рис. 18; рис. 33). В области центральных зубов следует исключить вестибулярное расположение имплантата, которое может привести к резорбции стенки лунки, обнажению резьбы имплантата, воспалительным явлениям и трудноустранимым эстетическим проблемам, в области премоляров имплантат желательно устанавливать по центру альвеолярного гребня, на уровне кости или на 2 мм ниже уровня альвеолярного гребня. Для такой установки желательно использовать имплантаты без полированной шейки, объединённых условным названием “Bone level” (см. рис. 9). При применении имплантатов данной конструкции можно рассчитывать на возникновение эффекта т.н. “переключения платформ” (Platform Switching) (рис. 9в), который многие имплантологи рассматривают в качестве стабилизационного механизма для периимплантных тканей и важного механизма достижения эстетического результата. Необходимость применения данной конструкции после удаления жевательной группы зубов не столь очевидная. В боковых отделах лучше использовать трансгингивальные имплантаты с полированной шейкой под условным называнием “Tissue level” (см. рис. 8).
Возможности немедленной имплантации могут быть ограничены дефектами альвеолярной кости, возникшими из-за заболеваний, послужившими причиной удаления данных зубов. Чаще всего это бывает из-за пародонтита, дефекты кости при котором могут достигать 50% и более длины корней удалённых зубов. Они могут быть не только односторонними, но и двух- и трёхстеночными. Значительные дефекты альвеолярной кости в области удалённого зуба могут являться противопоказанием для проведения немедленной имплантации. При установке имплантата может возникнуть несоответствие между лункой зуба и внутрикостной частью имплантата (рис. 33в). Образовавшийся таким образом дефект следует заполнить остеопластическим материалами: костной стружкой, измельчённой аутокостью или коллагеном (рис 33г), которые обладают остеокондуктивными и остеоиндуктивными свойства, или минеральными материалами, которые обладают только остеокондуктивными свойствами. Минеральные гранулы в связи с медленной резорбцией формируют низкое качество кости, что может отрицательно сказаться на остеоинтеграции и вторичной стабильности имплантатов. Кроме того, их необходимо изолировать барьерными мембранами, которые в случае расхождения швов не могут предохранить зону регенерации от инфицирования. Качество мягких тканей в области удалённого зуба не всегда достаточно хорошее для надёжной изоляции участка операции слизисто-надкостничным лоскутом без натяжения. В таких случаях используют различные методики слизисто-десневой хирургии: лоскут с дистальным смещением (Becker et al., 1990; 1994); лоскут на ножке или островной лоскут (Rosenquist, 1997); эпителиально-соединительно-тканный свободный аутотрансплантат слизистой оболочки в виде методики SSS (“Socket Seal Surgery” или “хирургия с замуровыванием альвеолы”) (Evian, Cutler, 1994; Landsberg, 1997); соединительнотканный свободный аутотрансплантат (Edel, 1995); расщеплённый нёбный лоскут на ножке (Nemcovsky, 1999) и др.
Результаты имплантации оцениваются функциональными возможностями созданной на их основе ортопедической конструкции и эстетическими параметрами. Решить функциональные задачи с помощью протезирования на имплантатах проще, чем добиться безупречного эстетического состояния. Для его оценки используют критерии т.н. «белой» или «красной» эстетики. Белая эстетика определяется параметрами искусственных коронок, их формой, цветом, оптическими свойствами, красная эстетика – состоянием дёсен и десневых сосочков в области ортопедической конструкции. Оба варианта имеют одинаково большое значение при высокой линии улыбки, при которой видна десна и десневые сосочки в области верхней челюсти. При отсутствии межзубных сосочков при улыбке между коронками и десной видны тёмные треугольники. В качестве компромиссного приёма можно создать иллюзию хорошей эстетики с помощью красной керамики. Таким образом, при информированном согласии пациентов, можно избежать необходимости проведения сложных и не всегда предсказуемых реконструктивных операций. Для решения данной задачи предпочитают в эстетически значимом фронтальном отделе имплантаты устанавливать на уровне или ниже альвеолярного гребня (“Bone Level”) и моделировать десну с помощью абатментов. Улучшить эстетический эффект и стабильности десневого края можно с помощью пластики свободным субэпителиальным десневым лоскутом.
Искусственные коронки на имплантаты изготавливают из металлокерамики и бескаркасной керамики из циркония. В основе металлокерамики находится металлический каркас, который уменьшает толщину керамической облицовки а, следовательно, снижает её оптические свойства. Бескаркасная керамика лишена данного недостатка, глубина светопреломления у неё больше, у неё более «живой» вид, по восприятию циркониевая коронка практически совпадает по внешнему восприятию с естественной коронкой зуба.
Остеоинтегрированные имплантаты при правильном планировании ортопедической конструкции способны функционировать в течение длительного времени. Функциональная нагрузка оказывает благотворное влияние на кровоснабжение и ремоделирование альвеолярной костной ткани, уменьшая вероятность её атрофии. Основной причиной преждевременной потери имплантатов является воспалительный процесс мягких тканей в области имплантата, который называется периимплантитом (рис. 34).

А

Б

В
А
Б
В
Рис. 34. Пац. Е., 62 года. Периимплантит в области пластиночного имплантата (а), установленного в области отсутствующих 26, 27 зубов, осложнённый хроническим верхнечелюстным синуситом (б).
Существуют объективные и субъективные предпосылки развития периимплантита. При формировании лоскута во время установки имплантата не следует нарушать прикрепление десны. Перемещение подвижной десны на уровень альвеолярного гребня может привести к постоянной травме и усложни гигиену в области имплантата. Десна возле имплантата должна быть достаточно кератенизированной. При тонком биотипе десны желательно улучшить её качество с помощью пластики свободным соединительнотканным аутотрансплантатом. Дополнительные риски развития периимплантита могут быть связаны со стремлением к эстетическим показателям протезирования на имплантатах. После установки имплантатов на уровне или ниже уровня альвеолярного гребня (“Bone level”) формируется глубокое десневое углубление, которое вместе с поддесневым соединением тела имплантата с абатментом может способствовать аккумулированию микрофлоры и развитию воспалительных явлений. Гигиена после таких реставраций должна быть особенно тщательной. Пациенту следует регулярно прочищать данные участки с помощью специальных нитей – флосов. В некоторых случаях ортопедическую конструкцию фиксируют не цементом, а крепят трансоклюзиальными винтами, которые позволяют врачу периодически снимать протез для проведения профессиональных гигиенических процедур. Гигиеническое состояние может значительно ухудшиться в случае атрофии альвеолярной кости и обнажения внутрикостной шероховатой поверхности имплантата, которая обладает выраженными ретенционными свойствами для пищевого налёта. В отличие от имплантатов, установленных на уровне или ниже уровня альвеолярного гребня, десна в области трансгингивальных имплантатов (“Tissue level”) прилегает к полированной шейке, а соединение с абатментом происходит на уровне десны, что снижает вероятность аккумулирования микрофлоры и предохраняет десну от воспалительных явлений. Имплантаты данной конструкции облегчают проведение гигиенических процедур, что особенно важно после протезирования в боковых отделах челюстей, где условия для гигиены более сложные, чем во фронтальном отделе челюстей. Ортопедическая конструкцию на имплантатах моделируют с учётом возможности проведения гигиенических мероприятий. Для этого без ущерба для эстетических характеристик формируют промывные зоны в области искусственных коронок и особенно в области промежуточной части мостовидных протезов.
После протезирования на имплантатах пациент должен быть мотивирован на проведение регулярной гигиены в области ортопедических конструкций. Важно объяснить пациенту основные принципы гигиены с использованием различных средств и инструментов, необходимость периодического посещения врача для проведения профилактических мероприятий. Основной целью гиены является тщательное удаление пищевого субстрата из придесневых участков с помощью щётки и средств межзубной гигиены, а критерием качества гигиены – отсутствие кровоточивости дёсен. При появлении кровоточивости пациент должен улучшить гигиену в данном участке, а при стойкой кровоточивости дёсен в области имплантатов – обратиться к врачу. Для проведения гигиены межзубных промежутков, особенно в области ортопедических конструкций, можно использовать флосы, суперфлосы (рис. 35а), зубные ёршики (рис. 35б). Однако их регулярное применение требует от пациента определённых усилий. Облегчить проведение межзубной гигиены можно с помощью ирригатора (рис. 35в), который позволяет промывать и прочищать труднодоступные участки сфокусированной струей воды под давлением (рис. 35г). Использование ирригатора повышает вероятность регулярного проведения межзубной гигиены и при отсутствии других причин исключает гигиеническую предпосылку развития периимплантита.

А

Б
А
Б

В

Г
В
Г
Рис. 35. Индивидуальная гигиена с помощью зубных нитей (а), зубных ёршиков (б) и ирригатора (в, г)
При появлении явлений мукозита важно своевременно купировать воспалительные явления и не допустить вовлечения в данный процесс альвеолярной костной ткани. При наличии воспалительной деструкции костной ткани в области имплантата следует провести кюретаж инфицированной грануляционной ткани, очищение внутрикостной части имплантата и пластику образовавшегося дефекта. Результаты хирургического лечения перимплантита не всегда предсказуемые и при прогрессировании процесса возможно удаление имплантата. В таком случае, прежде чем проводить повторную имплантацию, важно проанализировать причины периимплантита, что бы исключить его возникновение впредь.
Показания для имплантации по мере формирования доказательной научной базы постепенно расширяются. Среди заболеваний, при которых имплантация противопоказана, остаются: заболевания крови и свёртывающей системы; психические заболевания; инфекционные, в том числе вирусные (СПИД, гепатит В, С), заболевания в активной стадии; хронические заболевания, включая болезни обмена веществ и эндокринные заболевания, в стадии декомпенсации; онкологические заболевания во время проведения химео- и лучевой терапии. Не следует проводить имплантацию после недавно перенесённых инфаркта миокарда и инсульта, во время беременности и лактации. Однако даже при определённых рисках для остеоинтеграции не стоит отказывать пациенту с отягощённым анамнезом без веских на то оснований в праве на полноценную реабилитацию, которым является протезирование на имплантатах. Пациент перед проведением имплантации должен быть обследован, решение о возможности проведения имплантации у больных с отягощённым анамнезом следует принимать с учётом заключения врача-специалиста. Имплантация у пациентов со многими системными заболеваниями: сахарный диабет, остеопороз, заболевания щитовидной железы в компенсированном состоянии является достаточно эффективной хирургической процедурой. При этом, имплантологу следует знать и учитывать специфику сопутствующих заболеваний и влияние на организм препаратов или методов лечения, использованных для их лечения. Например, у пациентов с остеопорозом после лечения бисфосфонатными препаратами и пациентов с онкологическими заболеваниями возможны остеонекрозы челюстей (рис. 36а). Важно учитывать, что протезирование на имплантатах для пациентов с системными заболеваниями может являться единственным вариантом полноценной реабилитации и сохранения качества жизни (рис. 36б). Так, у пациентов с синдромом Шегрена из-за ксеростомии и ранимости слизистой оболочки полости рта использование съёмного пластиночного протеза затруднено из-за возможности мукозита.

А

Б
А
Б
Рис. 36. Протезирование на имплантатах у пациентов с остеопорозом (а) и синдромом Шегрена (б).
Если рассматривать имплантацию в качестве специализированного лечения, то даже у пациентов с гемофилией нельзя исключить возможность проведения имплантации в условиях гематологического стационара при соответствующей гемостатической терапии. У данных пациентов часто происходят кровоизлияния в суставы с развитием деформирующих артритов, по поводу чего приходиться устанавливать искусственные титановые суставы. В любом случае, для принятия врачебных решений с учётом существующих рисков имплантолог должен быть квалифицированным высокоэрудированным специалистом не только в челюстно-лицевой области, но и в самом широком понимании этого слова.
Литература:

© 2023, SoulMateClinic